Halófilos deteriorantes em produtos cárneos salgados
DOI:
https://doi.org/10.20873/jbb.uft.cemaf.v9n4.guedesPalavras-chave:
halófilos, archaea, alimentos cárneos, salgados, deterioração, controleResumo
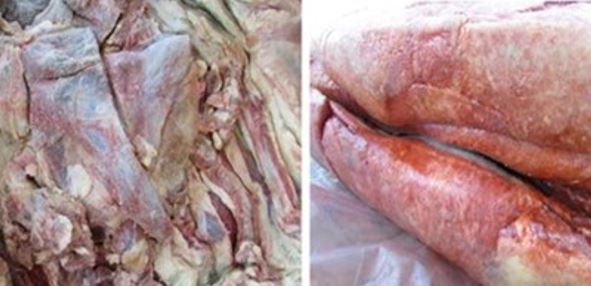
A utilização de cloreto de sódio em produtos cárneos além do seu efeito sensorial e conservante confere a eles uma estabilidade, pois diminui o crescimento microbiano e as reações química de degradação, prolongando a vida de prateleira. Apesar de ser utilizado para conservação de vários produtos, o sal quando não estéril pode conter microrganismos adaptados a altas concentrações salinas, denominados halófilos, estes podem ocasionar problemas de deterioração, como odores e aromas desagraváveis. São popularmente conhecidos como vermelhão por sua pigmentação colonial, e podem ser um problema econômico a indústrias de carnes e derivados salgados. O objetivo deste estudo é apresentar as principais características e medidas de controle de archaeas halófilas deteriorantes em produtos cárneos salgados por meio de um levantamento bibliográfico. Os procariotos pertencentes ao domínio Archaea e ao filo Euryarchoaeota são relatados como os principais organismos halofílicos descritas primeiramente como Halobacterium crescendo idealmente a 2 a 4 Mmol.L-1 de NaCl. Não sofrem desidratação, pois possui elevada concentração intracelular de sais (KCl) maior que a concentração de NaCl no seu habitat, são organismos de morfologia variada, maioria é gram-negativas, neutrófilas e mesófilas, havendo exceções. Para prevenir o aparecimento barreiras físico-químicas podem ser utilizadas destacando-se a embalagem a vácuo como também a utilização de ácidos orgânicos. A maior parte dos estudos sobre archaeas halofílicas tem se concentrado em pesquisas ambientais e ecológicas e poucos estudos são concentrados no isolamento e identificação a partir de alimentos salgados, nem tão pouco em medidas de controle que podem ser utilizadas para combater espécies deteriorantes.
Referências
Aiura FS, Carvalho MRB, Viegas EMM, Kirschnik PG, Lima TMA. Conservação de filés de tilápia-do-nilo (Oreochromis niloticus) em salga seca e salga úmida. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, v.60, p.1531-1537, 2008.
Akpolat C, Ventosa A, Birbir M, Sanchez-Porro C, Caglayan P. Molecular identification of moderately halophilic bacteria and extremely halophilic archaea isolated from salted sheep skins containing red and yellow discolorations. Journal of the American Leather Chemists Association, v. 110, no. 07, p. 211–226, 2015.
Amoozegar MA, Siroosi M, Atashgahi S, Smidt H, Ventosa A. Systematics of haloarchaea and biotechnological potential of their hydrolytic enzymes. Microbiology, v.163, n.5, p.623–645, 2017. https://doi.org/10.1099/mic.0.000463
Armenteros, M.; Aristoy, M.C.; Barat, J.M.; Toldrá, F. Bio-chemical and sensory changes in dry-cured ham salted with partial replacements of NaCl by other chloride salts, Meat Science, v. 90, p. 361–367, 2012.
Aykın-Dinçer E, Erbaş M. Drying kinetics, adsorption iso-therms and quality characteristics of vacuum-dried beef slic-es with different salt contents. Meat Science, v.145, p.114–120, 2018. https://doi.org/10.1016/j.meatsci.2018.06.007
Barns SM, Delwiche CF, Palmer JD, Pace NR. Perspectives on archaeal diversity, thermophily and monophyly from en-vironmental rRNA sequences. Proceedings of the National Academy of Sciences, v.93, n.17, p.9188–9193, 1996. https://doi.org/10.1073/pnas.93.17.9188
Borowitzka MA. Carotenoid Production Using Microorgan-isms. Single Cell Oils: Microbial and Algal Oils: Second Edition, p.225–240, 2010. https://doi.org/10.1016/B978-1-893997-73-8.50015-3
Brasil. Instrução Normativa Nº 92, de 18 de setembro de 2020. Dispõe Sobre a Identidade e os Requisitos de Quali-dade do Charque, da Carne Salgada Curada Dessecada, do Miúdo Salgado Dessecado e do Miúdo Salgado Curado Dessecado. 2020. Disponível em https://in.gov.br/en/web/dou/-/instrucao-normatia-n-92-de-18-de-setembro-de-2020-278692460. Acesso em 03 ago. 2021.
Brochier-Armanet C, Boussau B, Gribaldo S, Forterre P. Mesophilic crenarchaeota: proposal for a third archaeal phy-lum, the Thaumarchaeota. Nature Reviews Microbiology 2008 6:3, v.6, n.3, p.245–252, 2008. https://doi.org/10.1038/nrmicro1852
Brochier-Armanet C, Gribaldo S, Forterre P. Spotlight on the Thaumarchaeota. The ISME Journal. v.6, n.2, p.227–230, 2012. https://doi.org/10.1038/ismej.2011.145
Brochier-Armanet C, Forterre P, Gribaldo S. Phylogeny and evolution of the Archaea: one hundred genomes later. Cur-rent Opinion in Microbiology, v.14, n.3, p.274–281, 2011. https://doi.org/10.1016/J.MIB.2011.04.015
Campêlo MC. S Uso de conservadores naturais na elaboração de carne de sol com teores reduzidos de cloreto de sódio. 2016. 71 f. Dissertação (Mestrado em ciência animal). Uni-versidade Federal Rural do Semi-Árido, Mossoró.
Capes MD, Dassarma P, Dassarma S. The core and unique proteins of haloarchaea. BMC genomics, v.13, n.1, p.1-12, 2012. https://doi.org/10.1186/1471-2164-13-39
Cui HL, Lü ZZ, Li Y, Zhou Y. Salinirussus salinus gen. nov., sp. nov., isolated from a marine solar saltern. International Journal of Systematic and Evolutionary Microbiology, v.67, n.9, p.3622-3626, 2017. https://doi.org/10.1099/ijsem.0.002182
De Carvalho CCCR, Fernandes P. Production of metabolites as bacterial responses to the marine environment. Marine Drugs, v.8, n.3, p.705–727, 2010. https://doi.org/10.3390/md8030705
DeLong EF. Archaea in coastal marine environments. Pro-ceedings of the National Academy of Sciences, v.89, n.12, p.5685–5689, 1992. https://doi.org/10.1073/PNAS.89.12.5685
Elkins JG, Podar M, Graham DE, Makarova KS, Wolf Y, Randau L, Hedlund BP, Brochier-Armanet C, Kunin V, Anderson I, Lapidus A, Goltsman E, Barry K, Koonin E, Hugenholtz P, Kyrpides N, Wanner G, Richardson P, Keller M, Stetter KO. A korarchaeal genome reveals insights into the evolution of the Archaea. Proceedings of the National Academy of Sciences, v.105, n.23, p.8102–8107, 2008. https://doi.org/10.1073/PNAS.0801980105
Enquahone S et al. Molecular identification and evaluation of the impact of red heat damage causing halophilic microbes on salted hide and skin. International Biodeterioration & Bi-odegradation, v.150, p.104940, 2020.
Euzéby JP. LPSN - List of Prokaryotic names with Standing in Nomenclature. Disponível em: https://lpsn.dsmz.de/. Acesso em 23 de junho de 2021
Falb M, Müller K, Königsmaier L, Oberwinkler T, Horn P, von Gronau S, Gonzalez O, Pfeiffer F, Bornberg-Bauer E, Oesterhelt D. Metabolism of halophilic archaea. Extre-mophiles 2008 12:2, v.12, n.2, p.177–196, 2008. https://doi.org/10.1007/S00792-008-0138-X
Franco BDG, Landgraf M. Microbiologia de alimentos. São Paulo: Atheneu, 182p. 2008.
Freiberger RCDP. Utilização de ácidos orgânicos como con-servantes em linguiças curadas cozidas embaladas a vácuo. Ano de obtenção: 2016. 77 p. Dissertação (mestrado Ciência dos Alimentos) - Universidade Federal de Santa Catarina, Florianópolis.
Garcia CER, Bolognesi VJ, Shimokomaki M. Aplicações tecnológicas e alternativas para redução do cloreto de sódio em produtos cárneos. Boletim do Centro de Pesquisa de Processamento de Alimentos, v.31, n.1, p.139–150, 2013. https://doi.org/10.5380/CEP.V31I1.32715
Ghanmi F, Carré-Mlouka A, Zarai Z, Mejdoub H, Peduzzi J, Maalej S, Rebuffat S. The extremely halophilic archaeon Halobacterium salinarum ETD5 from the solar saltern of Sfax (Tunisia) produces multiple halocins. Research in Mi-crobiology, v.171, n.2, p.80–90, 2020. https://doi.org/10.1016/J.RESMIC.2019.09.003
Grant WD. Class III. Halobacteria class nov. Bergey's manual of systematic bacteriology, v.1, p.294-301, 2001
Guan Z, Naparstek S, Calo D, Eichler J. Protein glycosylation as an adaptive response in Archaea: growth at different salt concentrations leads to alterations in Haloferax volcanii S‐layer glycoprotein N‐glycosylation. Environmental microbi-ology, v.14, n.3, p.743-753, 2012. https://doi.org/10.1111/j.1462-2920.2011.02625.x
Gupta RS, Naushad S, Baker S. Phylogenomic analyses and molecular signatures for the class Halobacteria and its two major clades: a proposal for division of the class Halobacte-ria into an emended order Halobacteriales and two new or-ders, Haloferacales ord. nov. and Natrialbales ord. nov., containing the novel families Haloferacaceae fam. nov. and Natrialbaceae fam. nov. International Journal of Systematic and Evolutionary Microbiology, v.65, p.1050–1069, 2015. https://doi.org/10.1099/IJS.0.070136-0
Hayouni EA, Chraief I, Abedrabba M, Bouix M, Leveau J. Y, Mohammed H, Hamdi M. Tunisian. Salvia officinalis L. and Schinus molle L. essential oils: Their chemical compositions and their preservative effects against Salmonella inoculated in minced beef meat. International Journal of Food Microbi-ology, v.125, n.3, p.242–251, 2008. https://doi.org/10.1016/J.IJFOODMICRO.2008.04.005
Hohn MJ, Hedlund BP, Huber H. Detection of 16S rDNA sequences representing the novel phylum “Nanoarchaeota”: Indication for a wide distribution in high temperature bio-topes. Systematic and Applied Microbiology, v.25, n.4, p.551–554, 2002. https://doi.org/10.1078/07232020260517698
Hwang CY, Cho ES, Yoon DJ, Seo MJ. (Halobellus ruber sp. nov., a deep red-pigmented extremely halophilic archae-on isolated from a Korean solar saltern. Antonie van Leeuwenhoek 2021 114:7, v.114, n.7, p.997–1011, 2021. https://doi.org/10.1007/S10482-021-01571-1
Ishihara YM, Madruga MS. Indicadores de maciez em carnes salgadas e dessecadas: uma revisão. Semina: Ciências Agrá-rias, v.34, n.2, p.3721–3737, 2013. https://doi.org/10.5433/1679-0359.2013v34n6Supl2p3721
Klein C, Garcia-Rizo C, Bisle B, Scheffer B, Zischka H, Pfeif-fer F, Siedler F, Oesterhelt D. The membrane proteome of Halobacterium salinarum. Proteomics, v.5, n.1, p.180–197, 2005. https://doi.org/10.1002/PMIC.200400943
Krzmarzick MJ, Taylor DK, Fu X, McCutchan AL. Diversity and niche of archaea in bioremediation. Archaea, v.2018, 2018. https://doi.org/10.1155/2018/3194108
Lee HS. Diversity of Halophilic Archaea in Fermented Foods and Human Intestines and Their Application. Journal of Mi-crobiology and Biotechnology, v.23, n.12, p.1645–1653, 2013. https://doi.org/10.4014/JMB.1308.08015
Lin L, Hu JY, Wu Y, Chen M, Ou J, Yan WL. Assessment of the inhibitory effects of sodium nitrite, nisin, potassium sorbate, and sodium lactate on Staphylococcus aureus growth and Staphylococcal enterotoxin a production in cooked pork sausage using a predictive growth model. Food Science and Human Wellness, v.7, n.1, p.83–90, 2018. https://doi.org/10.1016/J.FSHW.2017.12.003
Lorentzen G, Wesmajervi Breiland MS, Østli J, Wang-Andersen J, Olsen RL. Growth of halophilic microorgan-isms and histamine content in dried salt-cured cod (Gadus morhua L.) stored at elevated temperature. LWT - Food Sci-ence and Technology, v.60, n.1, p.598-602, 2015. https://doi.org/10.1016/J.LWT.2014.08.035
Madigan MT, Martinko JM, Bender KS, Buckley DH, Stahl DA. Microbiologia de Brock: Artmed. 1006p. 2016.
Mantilla SPS, Mano SB, de Carvalho Vital H, Franco RM. Atmosfera modificada na conservação de alimentos. Revista Acadêmica Ciência Animal, v.8, n.4, p.437-448, 2010. http://dx.doi.org/10.7213/cienciaanimal.v8i4.11000
Moschetti G, Aponte M, Blaiotta G, Casaburi A, Chiurazzi M, Ventorino V, Villani F. Characterization of halophilic Ar-chaea isolated from different hypersaline ecosystems. An-nals of Microbiology, v.56, n.2, p.119–127, 2006. https://doi.org/10.1007/BF03174992
Munson-McGee JH, Field EK, Bateson M, Rooney C, Stepa-nauskas R, Young MJ. Nanoarchaeota, their Sulfolobales Host, and Nanoarchaeota virus distribution across Yellow-stone National Park hot springs. Applied and Environmental Microbiology, v.81, n.22, p.7860-7868, 2015. https://doi.org/10.1128/AEM.01539-15
Nunes ML, Pedro S. Tecnologias tradicionais: Salga do pes-cado. In: Gonçalves et al. Tecnologia do pescado: Ciência, Tecnologia, Inovação e Legislação. São Paulo: Atheneu, 156-165p. 2011.
Oesterhelt D, Krippahl G. Phototrophic growth of halobacteria and its use for isolation of photosynthetically-deficient mu-tants. In: Annales de l'Institut Pasteur/Microbiologie. Else-vier Masson, 137-150p. 1983. https://doi.org/10.1016/S0769-2609(83)80101-X
Ordoñez JA, Rodrigues MIC, Alvarez LF, Sanz MLG, Migui-llon G. Componentes dos Alimentos e Processos-Tecnologia de Alimento. Porto Alegre: Artmed, 294p. 2005.
Oren A. Diversity of halophilic microorganisms: environ-ments, phylogeny, physiology, and applications. Journal of Industrial Microbiology and Biotechnology, v.28, n.1, p.56-63, 2002. https://doi.org/10.1038/sj/jim/7000176
Oren A. Taxonomy of halophilic Archaea: current status and future challenges. Extremophiles, v. 18, n. 5, p. 825–834, 2014. https://doi.org/10.1007/S00792-014-0654-9
Oren A. The ecology of the extremely halophilic archaea. FEMS Microbiology Reviews, v.13, n.4, p.415–439, 1994. https://doi.org/10.1111/J.1574-6976.1994.TB00060.X
Oren A. The order Halobacteriales. In The Prokaryotes. A Handbook on the Biology of Bacteria, v.3, p.113-164, New York: Springer, 2006.
Paixão GC, Pantoja LDM, Brito EHS, Mourão CI. Desven-dando o mundo invisível da microbiologia. 2ª Ed. Fortaleza: EdUECE, 215p. 2015.
Petit T, Caro Y, Petit AS, Santchurn SJ, Collignan A. Physi-cochemical and microbiological characteristics of biltong, a traditional salted dried meat of South Africa. Meat Science, v.96, n.3, p.1313–1317, 2014. https://doi.org/10.1016/J.MEATSCI.2013.11.003
Pires ECC. Riqueza do domínio Archaea no solo do bioma Cerrado. Ano de obtenção: 2012. 83p. Dissertação (Mestra-do em Biologia molecular) - Universidade de Brasília, Brasí-lia.
Quadri I, Hassani II, l’Haridon S, Chalopin M, Hacène H, Jebbar M. Characterization and antimicrobial potential of extremely halophilic archaea isolated from hypersaline envi-ronments of the Algerian sahara. Microbiological Research, v.186-187, p.119–131, 2016. https://doi.org/10.1016/J.MICRES.2016.04.003
Rebouças L. de OS, Figueiredo JP. do V, Alves VCF, Campêlo MC da S, Oliveira PVC de, Souza JT, Firmino SS, Pereira G da S, Silva JBA, Lima PO. Diferentes pro-cessos de salga na qualidade de filés de tilápia (Oreochro-mis niloticus). Research, Society and Development, v.9, n.10, p. e1029108251, 2020. https://doi.org/10.33448/rsd-v9i10.825
Rios-Mera JD, Selani MM, Patinho I, Saldaña E, Contreras-Castillo CJ. Modification of NaCl structure as a sodium re-duction strategy in meat products: An overview. Meat Sci-ence, v.174, p. 108417, 2021. https://doi.org/10.1016/j.meatsci.2020.108417
Sahli K, Gomri MA, Esclapez J, Gómez‐Villegas P, Ghennai O, Bonete MJ, Kharroub K. Bioprospecting and characteri-zation of pigmented halophilic archaeal strains from Algeri-an hypersaline environments with analysis of carotenoids produced by Halorubrum sp. BS2. Journal of Basic Micro-biology, v.60, n.7, p.624-638, 2020. https://doi.org/10.1002/jobm.202000083
Silva M., Solidônio EG, Vivalvi MCV, Silva GR, Sena KXRF, Colaço W. Efeito da irradiação gama na redução da carga microbiana em Jerked Beef. Scientia Plena, v.9, n.8, p.1-7, 2013.
Søltoft-Jensen J, Hansen F. New Chemical and Biochemical Hurdles. Emerging Technologies for Food Processing, p. 387–416, 2005. https://doi.org/10.1016/B978-012676757-5/50017-7
Tobias AV, Arnold FH. (Biosynthesis of novel carotenoid families based on unnatural carbon backbones: A model for diversification of natural product pathways. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, v.1761, n.2, p.235–246, 2006. https://doi.org/10.1016/J.BBALIP.2006.01.003
Tortora G, Case C, Funke B. Microbiologia. Porto Alegre: Artmed, 962p. 2017.
Vidal VAS, Biachi JP, Paglarini CS, Pinton MB, Campagnol PCB, Esmerino EA, da Cruz AG, Morgano MA, Pollonio MAR. Reducing 50% sodium chloride in healthier jerked beef: An efficient design to ensure suitable stability, techno-logical and sensory properties. Meat Science, v.152, p.49–57, 2019. https://doi.org/10.1016/J.MEATSCI.2019.02.005
Woese CR., Kandler O, Wheelis ML. Towards a natural sys-tem of organisms: proposal for the domains Archaea, Bacte-ria, and Eucarya. Proceedings of the National Academy of Sciences, v.87, n.12, p.4576–4579, 1990. https://doi.org/10.1073/PNAS.87.12.4576
Yatsunami R, Ando A, Yang Y, Takaichi S, Kohno M, Matsumura Y, Ikeda H, Fukui T, Nakasone K, Fujita N, Sekine M, Takashina T, Nakamura S. Identification of ca-rotenoids from the extremely halophilic archaeon Haloarcula japonica. Frontiers in Microbiology, v.5, p.100, 2014. https://doi.org/10.3389/FMICB.2014.00100
Zhao X, Sun Y, Zhou Y. Modeling the NaCl diffusion in beef during brining process. Journal of Food Science, v.85, n.9, p.2852–2856, 2020. https://doi.org/10.1111/1750-3841.15382
Zhou GH, Xu XL, Liu Y. Preservation technologies for fresh meat – A review. Meat Science, v.86, n.1, p.119-128, 2010. https://doi.org/10.1016/J.MEATSCI.2010.04.033
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2024 - Journal of Biotechnology and Biodiversity

Este obra está licenciado com uma Licença Creative Commons Atribuição 4.0 Internacional.
Autores que publicam nesta revista concordam com os seguintes termos:
Autores mantêm os direitos autorais e concedem à revista o direito de primeira publicação, com o trabalho simultaneamente licenciado sob a Licença Creative Commons Attribution (CC BY 4.0 no link http://creativecommons.org/licenses/by/4.0/) que permite o compartilhamento do trabalho com reconhecimento da autoria e publicação inicial nesta revista.
Autores têm autorização para assumir contratos adicionais separadamente, para distribuição não exclusiva da versão do trabalho publicada nesta revista (ex.: publicar em repositório institucional ou como capítulo de livro), com reconhecimento de autoria e publicação inicial nesta revista.
Autores têm permissão e são estimulados a publicar e distribuir seu trabalho online (ex.: em repositórios institucionais ou na sua página pessoal) a qualquer momento antes ou durante o processo editorial, já que isso pode gerar alterações produtivas, bem como aumentar o impacto e a citação do trabalho publicado (disponibilizado em O Efeito do Acesso Livre no link http://opcit.eprints.org/oacitation-biblio.html).


