Preliminary results for genetic transformation of shoot tip of Eucalyptus saligna Sm. via Agrobacterium tumefaciens
DOI:
https://doi.org/10.20873/jbb.uft.cemaf.v2n1.silvaPalavras-chave:
Strain EHA105, GUS gene, Eucalypt, b-glucuronidaseResumo
A regeneração de plantas transgênicas de eucalipto
representa a maior dificuldade para a transformação genética de plantas do gênero Eucalyptus, além de que taxas baixas de plantas transformadas são alcançadas. O objetivo desse trabalho foi avaliar a acetosiringona no meio de co-cultura durante a transformação genética de ápices caulinares de Eucalyptus saligna via Agrobacterium tumefaciens e promover a seleção dos supostos explantes transformados. Ápices caulinares originados de brotações múltiplas foram usados como explantes. Estes explantes foram pré-cultivados por dois dias antes da transformação. A linhagem EHA105 de A. tumefaciens contendo o plasmídeo pBI120 foi utilizada. Os tratamentos foram: 0 e 100 μM de acetosiringona adicionada ao meio de co-cultura, após a co-cultura os explantes foram cultivados em meio de multiplicação suplementado com 250 mg.L-1 de cefotaxima e a cada subcultivo a concentração de canamicina foi aumentada, de 50 até 150 mg.L-1. A expressão transiente do gene uidA nos ápices caulinares foi avaliada no final da co-cultura e após sete dias em meio com canamicina (agente seletivo). A presença de 100 μM de acetosiringona no meio de co-cultura dos ápices caulinares de Eucalyptus saligna promoveu maior expressão transiente do gene uidA e retardou a ação tóxica causada pela canamicina.
Referências
AKAMA, K.; SHIRAISHI, H.; OHTA, S.; NAKAMURA, K.; OKADA, K.; SHIMURA, Y. (1992), Efficient transformation of Arabidopsis thaliana: comparison of the efficiencies with various organs, plant ecotypes and Agrobacterium strains. Plant Cell Reports, 12, 7-11.
BRONDANI, G. E.; DUTRA, L. F.; GROSSI, F.; WENDLING, I.; HORNIG, J. (2009), Establishment, multiplication and elongation in vitro of Eucalyptus benthamii Maiden & Cambage x Eucalyptus dunnii Maiden. Revista Árvore, 33, 11- 19.
BRONDANI, G. E.; WENDLING, I.; GROSSI, F.; DUTRA, L. F.; ARAUJO, M. A. (2010a), Eucalyptus benthamii × Eucalyptus dunnii minicutting technique: (ii) minicutting survival and rooting in relation to collection and seasons. Ciência Florestal, 20, 453- 465.
BRONDANI, G. E.; WENDLING, I.; GROSSI, F.; DUTRA, L. F.; ARAUJO, M. A. (2010b), IBA application for rooting of Eucalyptus benthamii Maiden and Cambage x Eucalyptus dunnii Maiden minicuttings. Acta Scientiarum. Agronomy, 32, 667-674.
CORRÊA, L. R.; PAIM, D. C.; SCHWAMBACH, J.; FETT- NETO, A. G. (2005), Carbohydrates as regulatory factors on the rooting of Eucalyptus saligna Smith and Eucalyptus globulus Labill. Plant Growth Regulation, 45, 63-73.
CRUZ, C. D. (2001), Programa Genes: versão Windows; aplicativo computacional em genética e estatística. Viçosa: UFV, Imprensa Universitária. p. 648.
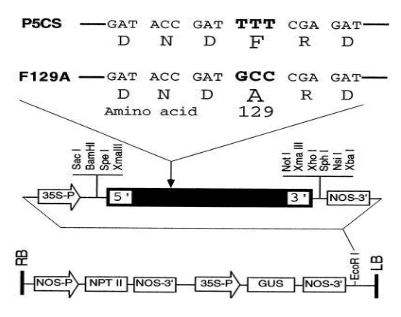
DIBAX, R.; DESCHAMPS, C.; BESPALHOK FILHO, J. C.; VIEIRA, L. G. E.; MOLINARI, H. B. C.; CAMPOS M. K. F.; QUOIRIN, M. (2010), Organogenesis and Agrobacterium tumefaciens-mediated transformation of Eucalyptus saligna with P5CS gene. Biologia Plantarum, 54, 6-12.
DIBAX, R. Transformação e expressão do gene PC5SF129-A em Eucalytus saligna. Tese (Doutorado em Agronomia) - Universidade Federal do Paraná, 2007.
DUTT, M.; LEE, D. H.; GROSSER, J. W. (2010), Bifunctional selection–reporter systems for genetic transformation of citrus: mannose- and kanamycin-based systems. In Vitro Cellular & Developmental Biology - Plant, 46, 467-476.
FERRAZ, E. S. B. AND COUTINHO, A. R. (1984), Efeitos da geada na madeira de Eucalyptus saligna. IPEF, 28, 57-62.
GRAAFF, E. E.; AUER, C. A.; HOOYKAAS, P. J. J. (2001), Altered development of Arabidopsis thaliana carrying the Agrobacterium tumefaciens ipt gene is partially due to ethylene effects. Plant Growth Regulation, 34, 305-315.
HONG, Z.; LAKKINENI, K.; ZHANG, Z.; VERMA, D. P. S. (2000), Removal of feedback inhibition of 1- Pyrroline-5-Carboxylate Synthetase results in increased Proline accumulation and protection of plants from osmotic stress. Plant Physiology, 122, 1129-1136.
HOOD, E. E.; GELVIN, S. B.; MELCHERS, L. S.; HOEKEMA, A. (1993), New Agrobacterium helper plasmids for gene transfer to plants. Transgenic Resource, 2, 208-218.
JEFFERSON, R. A.; KAVANAGH, T. A.; BEVAN, M. W. (1987), GUS fusions beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO Journal, 6, 3901-3907.
KARAVAIKO, N. N.; SELIVANKINA, S. Y. U.; KUDRYAKOVA, N. V.; MASLOVA, G. G.; BURKHANOVA, E. A.; ZUBKOVA, N. K.; KULAEVA, O. N. (2004), Is a 67-kD cytokinin-binding protein from barley and Arabidopsis thaliana leaves involved in the leaf responses to phenylurea derivatives? (A Review). Russian Journal of Plant Physiology, 51, 790-797.
LE ROUX, J. J. AND VAN STADEN, J. (1991), Micropropagation of Eucalyptus species. Hortscience, 26, 199-200.
MURASHIGE, T. AND SKOOG, F. (1962), Revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 15, 473-497.
SELLE, G. L. AND VUADEN, E. (2008), Efeitos da geada sobre plantações de Eucalypus grandis. Caderno de Pesquisa Série Biologia, 20, 36-44.
SILVA, A. L. L.; WALTER, J. M.; HORBACH, M. A.; QUOIRIN, M. (2007), Contenção do fluxo gênico de plantas geneticamente modificadas. Caderno de Pesquisa Série Biologia, 19, 18-26.
SILVA, A. L. L.; OLIVEIRA, Y.; ALCANTARA, G. B.; SANTOS, M.; QUOIRIN, M. (2009), Tolerância ao resfriamento e congelamento de folhas de eucalipto. Biociências, 17, 86-90.
SILVA, A. L. L.; OLIVEIRA, Y.; COSTA, J. L.; MASETTO, E.; MUDRY, C. S.; ERASMO, E. A. L.; SCHEIDT, G. N. (2010), Shoot tip and cotyledon explants of Eucalyptus saligna Sm. cultivated on different kanamycin levels. Journal of Biotechnology and Biodiversity, 1, 1-5.
VATANKHAH, E.; NIKNAM, V.; EBRAHIMZADEH, H. (2010), Activity of antioxidant enzyme during in vitro organogenesis in Crocus sativus. Biologia Plantarum, 54, 509-514.
VERVLIET, G.; HOLSTERS, M.; TEUCHY, H.; VAN MONTAGU, M.; SCHELL, J. (1975), Characterization of different plaque-forming and defective temperate phages in Agrobacterium strains. Journal of General Virology, 23, 33-48.
WALZ, A.; SEIDEL. C.; RUSAK, G.; PARK, S.; COHEN, J. D.; LUDWIG-MÜLLER, J. (2008), Heterologous expression of IAP1, a seed protein from bean modified by indole-3-acetic acid, in Arabidopsis thaliana and Medicago truncatula. Planta, 227, 1047-1061.
ZHANG, C-S.; LU, Q.; VERMA, D. P. S. (1995), Removal of feedback inhibition of 1-Pyrroline-5- Carboxylate Synthetase, a bifunctional enzyme catalyzing the first two steps of proline biossynthesis in plants. Journal of Biological Chemistry, 270, 20491-20496.
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Copyright (c) 2024 - Journal of Biotechnology and Biodiversity

Este obra está licenciado com uma Licença Creative Commons Atribuição 4.0 Internacional.
Autores que publicam nesta revista concordam com os seguintes termos:
Autores mantêm os direitos autorais e concedem à revista o direito de primeira publicação, com o trabalho simultaneamente licenciado sob a Licença Creative Commons Attribution (CC BY 4.0 no link http://creativecommons.org/licenses/by/4.0/) que permite o compartilhamento do trabalho com reconhecimento da autoria e publicação inicial nesta revista.
Autores têm autorização para assumir contratos adicionais separadamente, para distribuição não exclusiva da versão do trabalho publicada nesta revista (ex.: publicar em repositório institucional ou como capítulo de livro), com reconhecimento de autoria e publicação inicial nesta revista.
Autores têm permissão e são estimulados a publicar e distribuir seu trabalho online (ex.: em repositórios institucionais ou na sua página pessoal) a qualquer momento antes ou durante o processo editorial, já que isso pode gerar alterações produtivas, bem como aumentar o impacto e a citação do trabalho publicado (disponibilizado em O Efeito do Acesso Livre no link http://opcit.eprints.org/oacitation-biblio.html).


